听说,憋气30秒,可以鉴定你的肺是否健康。
快来检测一下!现在,开始憋气,直到圆点从A点抵达B点。
(图片来自网络)
什么?没有坚持到30秒!
那我很遗憾的告诉您,这个结果并不能真实反映您的肺部健康状况(顶锅跑)~只能说明,您的肺活量较小,是不是好久没运动啦?
虽然这一测试无法判定肺的健康状况,但你是否感受到了呼吸的重要性。每时每刻,新鲜的空气正通过气管进入温暖的胸腔,其中的氧气从肺中滤出,随着血液奔向大脑,四肢…
今天,我们便来介绍下人体呼吸中枢——肺,主要包括它的结构,细胞类型,相关重大疾病及动物模型。
肺的生理结构
正常的肺呈浅红色,位于胸腔,覆盖在心脏之上。左右胸腔各有肺叶,左二右三,右肺可以分为上、中、下三叶,左肺则仅有上、下两叶,所以人体的肺一共有五叶。每个肺叶之间有胸膜隔开,各自有支气管与主气管相通,彼此之间没有联系。
每次呼吸,空气通过鼻腔进入气管,再进入支气管。支气管分为左右主干支气管,其组成与气管相似,并逐渐分枝成更小的分支——气管支气管树,对吸入的空气进行引导、加湿和加热。终末支气管最后形成小肺泡簇,肺泡总数达到数百万。肺泡被毛细血管网所包围。通过毛细血管的薄膜,空气和血液进行氧气和二氧化碳的交换[1]。
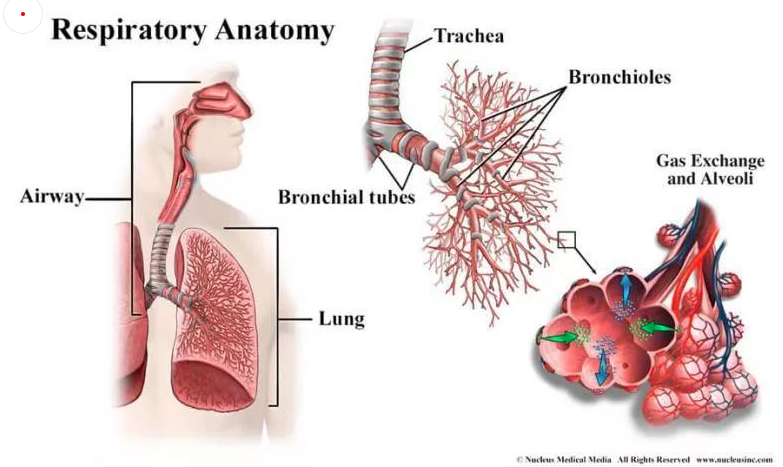
图1 呼吸系统示意图(引自https://www.nhlbi.nih.gov/health-topics/how-lungs-work)
肺的细胞分型
肺部细胞是肺执行生理功能的基本单位,通过了解其种类和状态,人们可以进一步研究肺部疾病的发生机理,进行精确有效的治疗。通过显微镜观察,免疫荧光标记等传统方法,已知晓的人体肺部细胞类型有45种。而科学家借助刚刚兴起的单细胞测序技术,从另一个维度绘制出人体更多的肺部细胞种类及表达状态,确定了成人肺中有58种转录上不同的细胞群体,包括15种上皮细胞,9种内皮细胞,9种基质细胞(图2)和25种免疫细胞(图3)[2]。
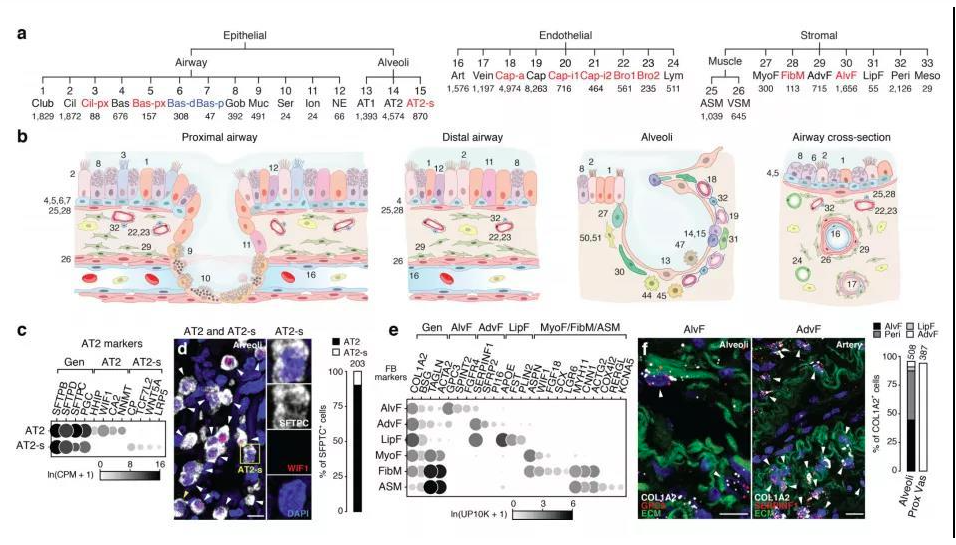
图2 肺部上皮细胞、内皮细胞和基质细胞群分类及组织学定位[2]
而归纳出的这58种细胞中包含41种已知的肺部细胞类群,不包含原本被认为存在的4种细胞,即神经元、神经胶质,簇状细胞以及嗜酸粒细胞。对该研究结果感兴趣的小伙伴可以在公众号中索要原文。下面将挑选两大类含量最多的肺部细胞(上皮细胞和内皮细胞)做简要介绍。
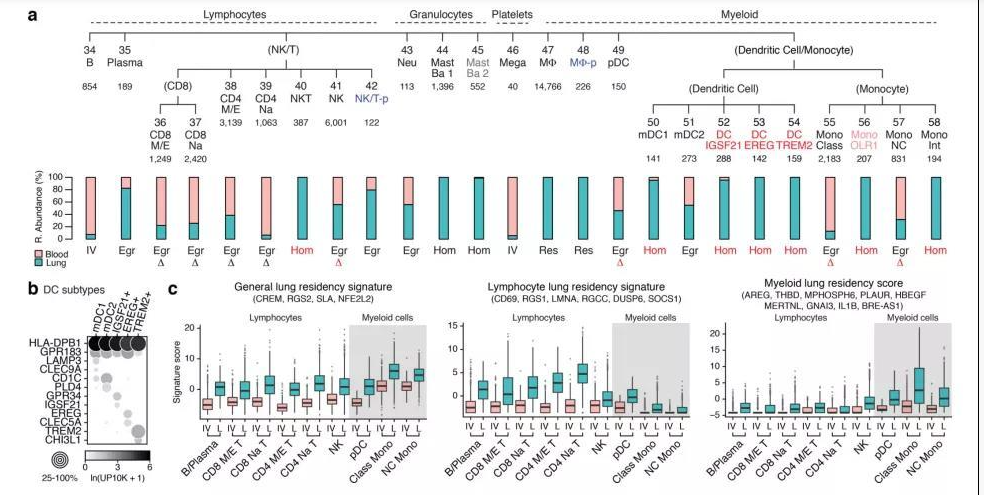
图3 肺免疫细胞分群[2]
肺泡上皮细胞
肺泡上皮细胞作为气体交换的单位(图4),维持着肺脏的基本功能。肺泡上皮细胞主要由I型肺泡上皮细胞,Ⅱ型肺泡上皮细胞组成。
肺泡I型细胞,其表面标志物是水通道蛋白5(AQP5)占肺泡表面积的96%。这些细胞非常薄,呈鳞状,它们与肺毛细血管内皮共用一个基底膜,形成气血屏障,在此发生气体交换。
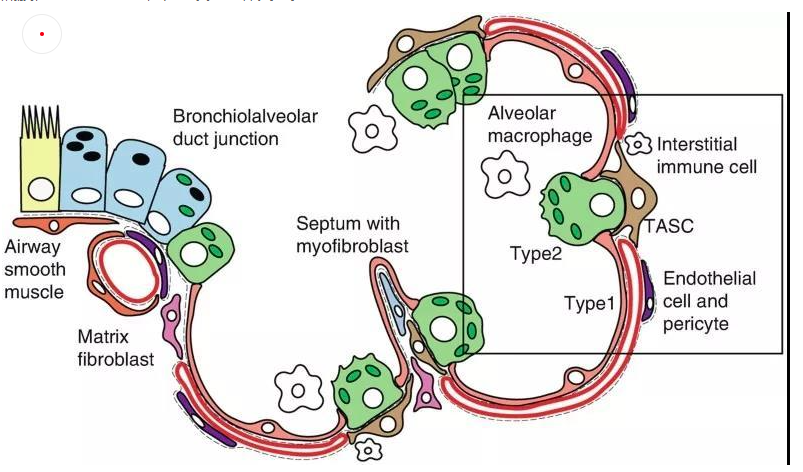
图4 小鼠肺泡区示意图[4]
II型细胞为球形肺细胞,其表面标志物为SFTPC(又称为SPC),仅占肺泡表面积的4%,但占肺泡上皮细胞的60%,占全部肺细胞的10-15%。Ⅱ型肺泡细胞位于肺泡拐角处,具有合成、分泌肺表面活性物质的功能,还可调节肺泡水分,兼有分化成I型细胞的作用[3]。
肺部内皮细胞
内皮细胞位于渗透在肺部的血管上,它不仅是血液,空气和基质组织之间的物理屏障,还具有代谢活性,参与炎症控制、白细胞运输、血管生成和血管张力等过程。根据最新的单细胞测序结果,肺脏内皮细胞可分为淋巴内皮细胞、动脉内皮细胞、普通毛细血管内皮细胞(General capillary, gCap )、气管细胞(Aerocyte)、肺静脉内皮细胞和全身静脉内皮细胞[5]。
其中,参与气体交换的是肺泡毛细血管内皮细胞,由“气管细胞”和普通毛细血管内皮细胞共同组成。“气管细胞”专门用于气体交换和白细胞运输,是肺独有的内皮细胞;普通毛细血管内皮细胞用于调节血管舒缩张力,并在毛细血管稳态和修复中充当干细胞/祖细胞(图5)[6]。
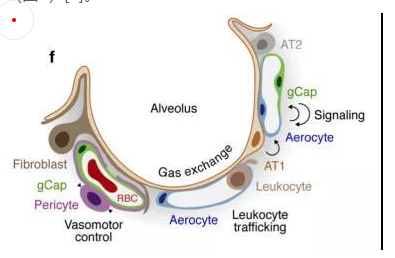
图5 肺泡气体交换示意图[6]
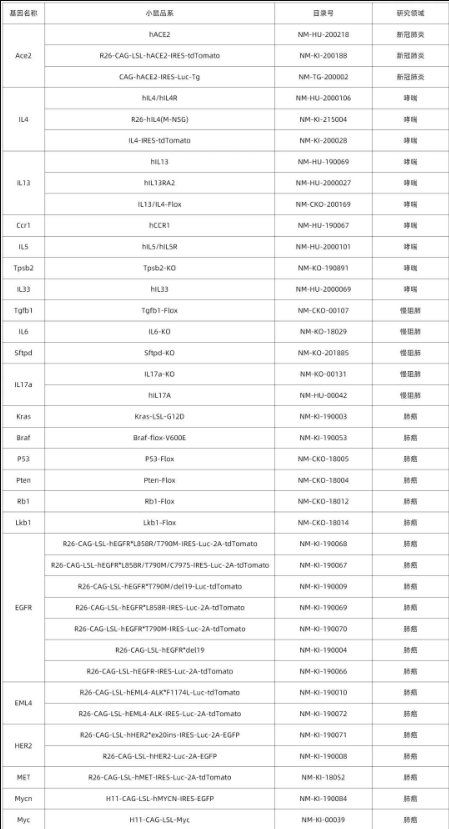
南模生物在小鼠肺部细胞特定marker基因中敲入Cre/Dre重组酶元件或报告基因,研究者可以对每类细胞进行标记,还可以在特定细胞群里进行基因及细胞功能的研究。具体模型信息见下表:
表1 肺部特定细胞工具鼠
作为重要的呼吸器官,肺部随时会侵入细菌、病毒、真菌、尘埃等,造成不同类型的肺部疾病,如新冠肺炎,大叶性肺炎,支气管炎等,严重的可导致急性或慢性呼吸衰竭及各类肺癌。目前,人们对这些疾病发病机制还不够了解,因此治疗措施十分缺乏。为深入研究疾病的发生发展,相关研究动物模型的构建是必不可少的一环。
新冠肺炎研究模型
自新冠疫情爆发以来,截至2021年11月8日,全球新冠肺炎累计确诊病例已经超过2.5亿例,全球累计死亡病例超过505万例。
ACE2 是此次新冠病毒感染人体的主要结合受体。新冠病毒的刺突糖蛋白可以与肺上皮细胞细胞膜上的 ACE2特异性的结合。通过脂质胞膜的内吞作用,病毒颗粒与囊泡融合并快速进入宿主细胞内[7]。但小鼠细胞不具有结合新冠病毒蛋白的能力,因此可以将人ACE2的转入到小鼠体内,这种小鼠感染SARS-CoV-2后的肠道、肺炎症状及病理学特征与COVID-19患者很相似[8]。南模生物自主研发了CAG-hACE2-IRES-Luc-Tg(hACE2-Tg) 小鼠,可以作为疫苗和药物研发的重要工具。详细介绍可见往期推文:传染病研究杀手锏——常用动物模型介绍
慢性阻塞性肺炎研究模型
慢性阻塞性肺炎(chronic obstructive pulmonary emphysema,COPD)又称阻塞性肺气肿,具有终末细支气管远端部分(包括呼吸性细支气管、肺泡管、 肺泡囊和肺泡)膨胀,并伴有气腔壁的破坏的表现。目前,我国慢阻肺患者人数约1亿,已经成为与高血压、糖尿病“等量齐观”的慢性疾病,构成重大疾病负担[9]。
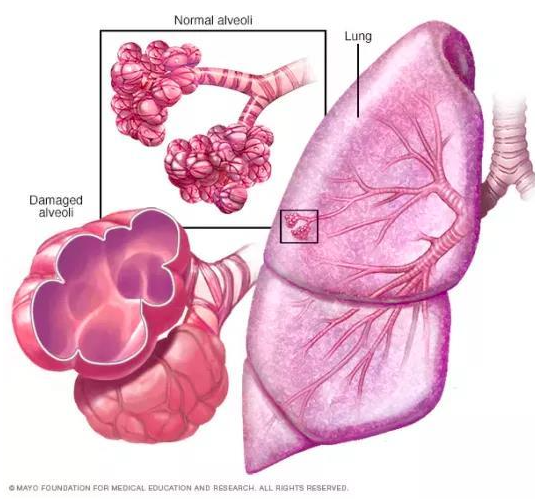
图6 正常的肺泡和损伤后的肺泡对比图,损伤后的肺泡失去弹性并过度膨胀(图片来自网络)
常规COPD诱导模型
目前最常用的COPD动物模型是小鼠。通过在香烟烟雾中暴露 6个月,小鼠显示出人类COPD的一些特征,如慢性肺部炎症、中度气道扩增和轻度小气道纤维化[10]。此外,通过弹性蛋白酶进行气管滴注、微生物及其产物诱导或者其他化学物质诱导,也有构建成功的先例[11]。
基因修饰COPD自发模型
随着基因修饰技术的发展,通过调控COPD相关基因的表达,建立基因工程小鼠模型的应用呈上升趋势。表面活性剂蛋白(Surfactant protein, SP)-D是一种模式识别分子,属于胶原凝集素蛋白家族。SP-D的主要功能是结合病原微生物或者寄生虫,这些生物通过调理作用被中性粒细胞清除,从而被吞噬细胞识别。临床中发现具有较高的SP-D水平的患者,其因COPD产生的风险较低,肺功能下降速度较缓慢。Sftpd基因(编码SP-D蛋白)敲除小鼠可出现肺气肿、进行性隔膜壁厚度和胸膜下纤维化,提示这些动物出现肺内肺气肿和纤维化的联合表型[12]。
COPD靶点研究模型
IL-17a是COPD中性粒细胞气道炎症的关键介质。升高的血清IL-1β和 IL-17a水平可作为COPD持续性中性粒细胞气道炎症和潜在持续恶化的生物标志物。阻断IL17a/IL17RA可有效降低香烟烟雾诱导的MUC5AC蛋白、IL6、TNFα和IL-1β等炎症因子在支气管上皮细胞中的表达。在小鼠体内特异性敲除IL17a则有益于减少中性粒细胞向气道的募集[13]。这些结果提示靶向IL17a是潜在的COPD治疗手段。
COPD患者除了明显的肺部特征之外,还存在体重减轻的状况。临床上发现,COPD患者的痰液和血清中的白细胞介素-6 (IL-6)水平较高。因此,科学家通过构建IL6敲除小鼠,与野生型进行对比,验证IL6对COPD疾病发生的影响。研究结果发现,野生型小鼠和 IL6敲除小鼠同时进行香烟烟雾暴露,IL6敲除小鼠具有较低的体重,血清瘦素水平和脂肪组织质量,提示IL-6可作为体重的调节因子[14]。
南模生物可提供COPD相关基因及治疗靶点敲除小鼠和人源化小鼠,助力COPD相关研究(见文末表3)。
哮喘研究模型
哮喘又名支气管哮喘。支气管哮喘是由多种细胞及细胞组分参与的慢性气道炎症。目前对哮喘的根本病因尚不能完全了解。罹患哮喘的最大风险因素是遗传易感性与环境接触(吸入可能诱发过敏反应或刺激气道的物质和颗粒)二者的结合,这类物质和颗粒包括室内过敏源(例如家庭尘螨)、室外过敏源(例如花粉)和烟草烟雾等[15]。
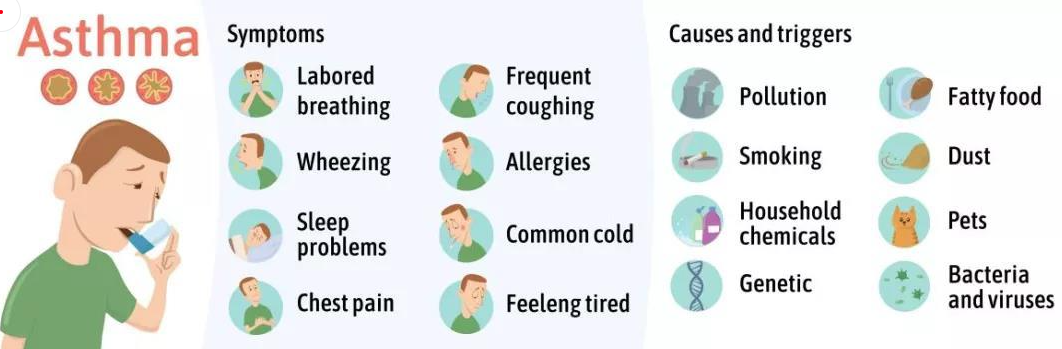
图7 哮喘产生的症状和致敏源
尘螨(HDM)是屋尘过敏的主要过敏源。在已有的研究中证明了尘螨在哮喘的发展中及诱发其他过敏性疾病(如皮炎和鼻炎)中起重要作用[16]。HDM的粪便颗粒中含有多种过敏原,这些过敏原是全世界过敏性哮喘的主要诱因,可通过局部使用HDM开发具有临床相关意义的小鼠模型。南模生物可提供尘螨诱导的哮喘模型,详细验证数据如下。图1为野生型C57BL/6小鼠经尘螨诱导后免疫细胞数量变化的结果,对照组小鼠相比,中心粒细胞、淋巴细胞和嗜酸性细胞的数量有明显的增加。

图8 C57BL/6小鼠在尘螨诱导后各类免疫细胞数量的变化
绝大多数哮喘患者发作时可通过抗炎、平喘等传统治疗药物得到控制,但仍有部分患者的病情需要借助全身应用高剂量激素才可缓解或仍无法控制,甚至威胁生命。近年来,针对这些难治性重症哮喘,人们开发了新的靶向药物并应用于临床。目前已上市的靶向药有奥马珠单抗(抗IgE),IL-5/IL-5R单抗。高潜力在研的重度哮喘药物有IL-4/IL-13单抗;TSLP抗体;IL-33/ST-2单抗等。南模生物可提供相应靶点的人源化小鼠,助力靶向创新药物的研发和筛选(见文末表3)。
肺癌研究模型
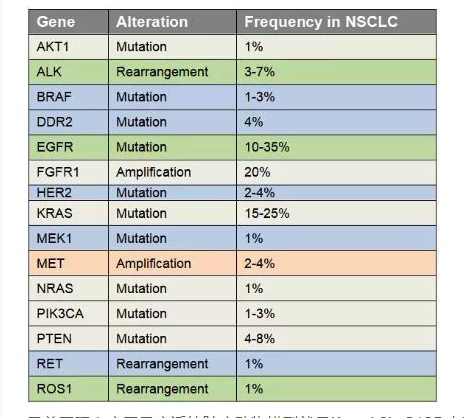
肺癌是起源于上皮组织的恶性肿瘤,在我国各种恶性肿瘤中发病率和死亡率均排名第一,好发年龄在70岁以上,男女发病率之比为2:1。由于空气污染、放射性暴露以及肺部真菌感染等原因,使得肺癌的发病率和死亡率久居不下。肺癌主要分为非小细胞肺癌(non small cell lung cancer, NSCLC)和小细胞肺癌(small celllung cancer, SCLC),其中非小细胞肺癌约占肺癌的80~85%[17]。在非小细胞肺癌中,发现很多驱动突变,常见的驱动突变包括Kras突变、EGFR突变、FGFR1扩增、ALK重排、HER2突变、MET扩增、BRAF突变等[17]。研究人员对肺癌的多个突变进行探究,将肺癌中发现的突变进入引入到小鼠中,从而获得多种用于研究肺癌发生与转移机制、筛选和评价抗肿瘤药物的肺癌模型。
表2 非小细胞肺癌中基因突变频率和类型[17]
目前国际上应用最广泛的肺癌动物模型就是Kras-LSL-G12D小鼠模型,可以通过与肺上皮细胞特异性的Cre转基因小鼠杂交来实现Kras突变体的激活,从而导致肺癌的发生。南模生物提供的Kras(LSL-G12D/+)小鼠品系在Kras突变基因的上游插入了loxp-stop-loxp终止序列,其在没有cre重组酶的条件下是不表达的。Cre介导的重组可去除终止密码子,使致癌基因表达。采用腺病毒载体携带Cre感染肺部细胞后,导致肺肿瘤发生的频率非常高(图8)。
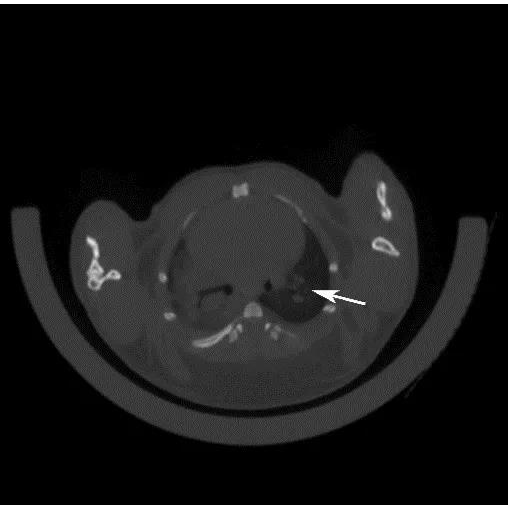
图9 采用气管内注射的方法,将AAV-cre病毒注射到小鼠肺部,3个月后对小鼠肺部进行CT检测,CT结果显示有明显的肿瘤的形成。
此外,我们还可以提供Kras(LSL-G12D/+)小鼠肿瘤细胞来源的同系荷瘤小鼠模型。肿瘤细胞可在受体小鼠体内快速增殖(如图9)。荷瘤小鼠模型可提高临床药效评价实验操作的简便性。
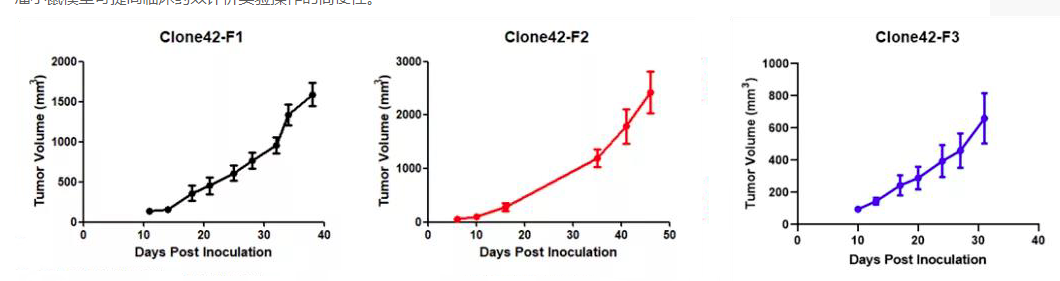
图10 荷瘤小鼠体内肿瘤细胞体积随时间增长的变化
关于肺癌的详细介绍可见往期推文:基因工程小鼠疾病模型系列——肺癌篇
南模生物肺病动物模型
南模生物自主构建了多种基因修饰小鼠(表3),可以用于新冠肺炎、慢性阻塞性肺炎、哮喘、肺癌等疾病的研究和药物筛选。
表3 肺部疾病相关动物模型列表
南模生物深耕基因编辑领域,提供全方位模式生物服务,包括基因修饰成品模型供应、个性化模型定制、饲养繁育、表型分析、药效评价等,满足不同实验室需求。
Reference:
[1] https://www.nhlbi.nih.gov/health-topics/how-lungs-work
[2] Travaglini KJ, Nabhan AN, Penland L, et al. A molecular cell atlas of the human lung from single-cell RNA sequencing. Nature. 2020 Nov;587(7835):619-625.
[3] https://www.ncbi.nlm.nih.gov/books/NBK557542/
[4] Hogan B.L.M. (2020) The Alveolar Stem Cell Niche of the Mammalian Lung. In: Nakanishi T., Baldwin H., Fineman J., Yamagishi H. (eds) Molecular Mechanism of Congenital Heart Disease and Pulmonary Hypertension. Springer, Singapore. https://doi.org/10.1007/978-981-15-1185-1_2
[5] Schupp JC, Adams TS, Cosme C Jr, et al. Integrated Single-Cell Atlas of Endothelial Cells of the Human Lung. Circulation. 2021 Jul 27;144(4):286-302. doi: 10.1161/CIRCULATIONAHA.120.052318.
[6]Gillich A, Zhang F, Farmer CG, Travaglini KJ, Tan SY, Gu M, Zhou B, Feinstein JA, Krasnow MA, Metzger RJ. Capillary cell-type specialization in the alveolus. Nature. 2020 Oct;586(7831):785-789. doi: 10.1038/s41586-020-2822-7.
[7] Bohn MK, Hall A, Sepiashvili L, Jung B, Steele S, Adeli K. Pathophysiology of COVID-19: Mechanisms Underlying Disease Severity and Progression. Physiology (Bethesda). 2020 Sep 1;35(5):288-301.
[8] Jiang RD, Liu MQ, Chen Y, et al. Pathogenesis of SARS-CoV-2 in Transgenic Mice Expressing Human Angiotensin-Converting Enzyme 2. Cell. 2020 Jul 9;182(1):50-58.e8.
[9]Wang C, Xu J, Yang L, Xu Y, et al; China Pulmonary Health Study Group. Prevalence and risk factors of chronic obstructive pulmonary disease in China (the China Pulmonary Health [CPH] study): a national cross-sectional study. Lancet. 2018 Apr 28;391(10131):1706-1717.
[10]Churg A, Cosio M, Wright JL. Mechanisms of cigarette smoke-induced COPD: insights from animal models[ J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(4): L612-L631.
[11]李丽球, 谢丽华, 孙圣华. 慢性阻塞性肺疾病动物模型的研究进展[J]. 中南大学学报:医学版, 2017, 42(9):6.
[12] Barreiro E, Wang X, Tang J. COPD: preclinical models and emerging therapeutic targets. Expert Opin Ther Targets. 2019 Oct;23(10):829-838. doi: 10.1080/14728222.2019.1667976. Epub 2019 Sep 20. PMID: 31512957.
[13] Wu M, Lai T, Jing D,et al. Epithelium-derived IL17A Promotes Cigarette Smoke-induced Inflammation and Mucus Hyperproduction. Am J Respir Cell Mol Biol. 2021 Jun 29.
[14] Pauwels NS, Bracke KR, Maes T, et al. The role of interleukin-6 in pulmonary and systemic manifestations in a murine model of chronic obstructive pulmonary disease. Exp Lung Res. 2010 Oct;36(8):469-83.
[15]https://www.who.int/zh/news-room/fact-sheets/detail/asthma
[16]Tang W, Dong M, Teng F, Cui J, Zhu X, Wang W, Wuniqiemu T, Qin J, Yi L, Wang S, Dong J, Wei Y. Environmental allergens house dust mite-induced asthma is associated with ferroptosis in the lungs. Exp Ther Med. 2021 Dec;22(6):1483.
[17]Min-chul Kwon, Anton Berns. Mouse models for lung cancer. MOLECULAR ONCOLOGY 7 (2013) 165e177.




 17312606166
17312606166